Comme nous le rappelle France Hydrogène sur son site, la décomposition de l’eau par électrolyse s’écrit de permet de séparer l’oxygène de l’hydrogène (H2O → H2 + ½ O2). Cette décomposition nécessite un apport d’énergie électrique dépendant essentiellement de l’enthalpie et de l’entropie de réaction. Les valeurs classiques des potentiels de cellules industrielles sont de l’ordre de 1,7 à 2,1 V, ce qui correspond à des rendements d’électrolyse de 70 à 85 %. La consommation électrique des électrolyseurs industriels (auxiliaires compris) est généralement de 4 à 5 kWh/Nm3 d’hydrogène produit.
L’alimentation minimale en eau d’un électrolyseur est de 0,8 L/Nm3 d’hydrogène produit. En pratique, la valeur réelle est proche de 1 L/Nm3. L’eau introduite doit être la plus pure possible car les impuretés demeurent dans l’équipement et s’accumulent au fil de l’électrolyse, perturbant in fine les réactions électrolytiques par :
- La formation de boues,
- L’action des chlorures sur les électrodes.
Une spécification importante sur l’eau porte sur sa conductivité ionique (qui doit être inférieure à quelques μS/cm). Une cellule d’électrolyse est constituée de deux électrodes (anode et cathode, tous deux conducteurs électriques) reliées à un générateur de courant continu, et séparées par un électrolyte (milieu conducteur ionique).
Cet électrolyte peut être :
- Soit une solution aqueuse acide ou basique,
- Soit une membrane polymère échangeuse de protons,
- Soit une membrane céramique conductrice d’ions O2-.
Il existe de nombreux fournisseurs proposant des technologies très diversifiées, notamment en termes de nature de l’électrolyte et de technologie associée, allant d’un possible couplage amont avec une alimentation électrique renouvelable (photovoltaïque ou éolienne), à la fourniture finale directe d’hydrogène sous pression.
Les technologies
Elles sont de deux natures et portent d’une part sur le type de structure (monopolaire ou bipolaire) et d’autre part sur le type d’électrolyte : alcalin, PEM2 (ou acide) ou SOEC (technologie SOFC). Les premiers appareils d’électrolyse disposaient d’électrodes monopolaires (c’est-à-dire que chaque anode est connectée au pôle positif et chaque cathode au pôle négatif), les cellules d’électrolyse fonctionnent alors en parallèle. Les systèmes bipolaires, développés par la suite, utilisent des plaques intercalaires jouant le rôle d’anode d’un côté et de cathode de l’autre, les cellules d’électrolyse fonctionnent alors en série. La conduction électrique s’opère à l’intérieur de l’électrode au travers de son épaisseur qui présente une chute ohmique, faible mais non nulle. Les assemblages bipolaires offrent l’avantage d’une densité de courant plus élevée et d’une meilleure compacité. Cette conception introduit cependant une difficulté supplémentaire : l’électrode présente une face en milieu oxydant (anode) et l’autre en milieu réducteur (cathode). La grande majorité des systèmes industriels reposent sur la technologie bipolaire, alors que quelques fournisseurs d’électrolyseurs de petite capacité proposent encore des structures mono polaires. Les cellules d’électrolyse doivent être étanches, isolées électriquement et résistantes à la corrosion dans des conditions de température et pression parfois élevées.
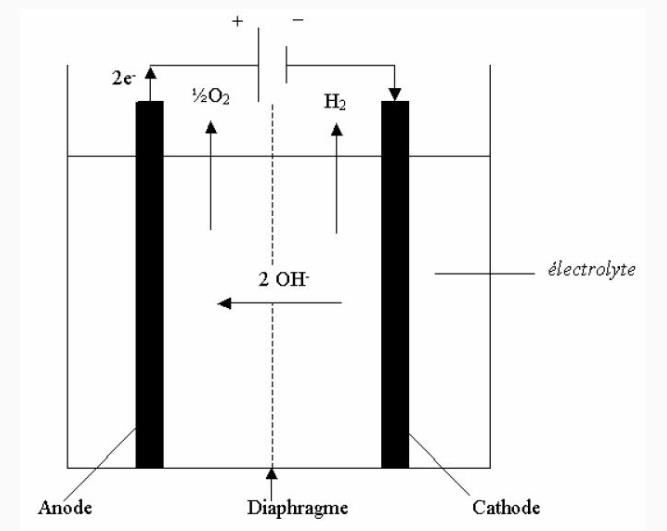
À l’anode : 2 OH — → ½ O2 + H2O + 2 e-
A la cathode : 2 H2 + 2 e- → H2 + 2 OH-
(Source : France Hydrogène — Th. Alleau, revu février 2023)
Électrolyse alcaline
L’électrolyse alcaline est le procédé le plus employé dans l’industrie et est donc mature. Les électrolyseurs se présentent en modules de petite ou moyenne capacité (0,5–800 Nm3/h d’hydrogène), utilisant une solution aqueuse d’hydroxyde de potassium (ou potasse KOH) dont la concentration varie en fonction de la température (typiquement de 25 % en masse à 80 °C jusqu’à 40 % à 160 °C). La potasse est préférée à la soude, essentiellement pour des raisons de conductivité ionique supérieure à niveaux de température équivalents, et de meilleur contrôle des impuretés chlorures et sulfates. Inconvénient, le KOH, délicat à manipuler, peut présenter de problèmes de corrosion.

Les modules comprennent généralement : une alimentation électrique, des cellules d’électrolyse, une unité de purification de l’eau, une unité de déshumidification des gaz, une unité de purification de l’hydrogène, un compresseur et un système de contrôle-commande. Certaines technologies d’électrolyseurs fonctionnent directement sous pression. Les modules de petite capacité opèrent typiquement de 3 à 30 bars.
À noter que plusieurs laboratoires mènent des travaux de R&D sur les piles à combustible alcalines pour remplacer l’électrolyte liquide par des membranes solides conductrices d’anions OH-. En cas de succès, non encore acquis, ces membranes pourraient trouver une application dans l’électrolyse alcaline.
Une autre technologie alcaline : l’AEM avec des modules de 1 MW de puissance est en développement. Ce procédé est une variante d’électrolyseur alcalin avec un électrolyte collé imbibé mais sans solution aqueuse. Plus compacte, moins coûteuse en consommable, elle pourrait apporter une plus-value en sécurité et en coût.
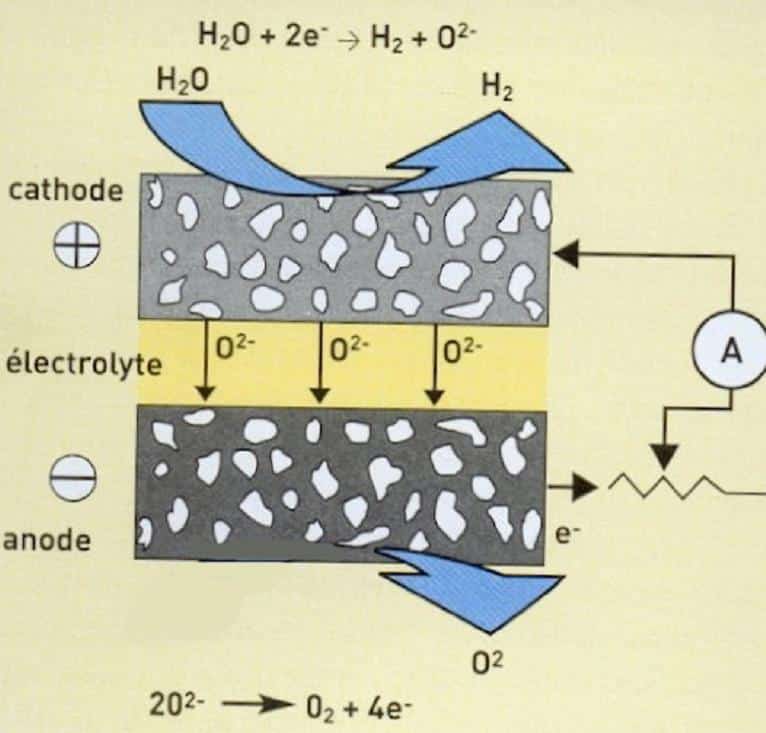
SOEC : Solid Oxide Electrolysis Cell
Électrolyse acide PEM (Proton Exchange Membrane)
L’électrolyse acide se distingue de la précédente par un électrolyte solide à membrane polymère conductrice de protons (voir schéma). Les avantages de cette technologie sont l’absence d’électrolyte liquide, la compacité, la simplicité du design et du fonctionnement, la limitation des problèmes de corrosion, des performances sensiblement supérieures et une moindre influence de la variation des conditions d’entrée (intéressant pour les sources renouvelables intermittentes). Cependant, le coût de la membrane polymère et l’utilisation d’électro-catalyseurs à base de métaux nobles conduisent à des équipements aujourd’hui plus onéreux que les électrolyseurs alcalins de même capacité. L’électrolyse à membrane polymère est considérée, néanmoins, par beaucoup, comme une technologie d’avenir, car elle bénéficie des nombreux développements sur les piles à combustible de technologie comparable et de la réduction des coûts associée.
Ces unités peuvent opérer de la pression atmosphérique à plusieurs dizaines de bars, voire quelques centaines de bars. Ce type d’électrolyseur est particulièrement adapté au couplage à une source d’énergie renouvelable, car il supporte, mieux que l’électrolyseur alcalin, les variations de puissance électrique disponible. Les rendements des deux familles d’électrolyseur sont aujourd’hui très proches l’un de l’autre et approchent, pour les plus puissantes, une valeur voisine de 90 %. Les normes et codes sur la conception et/ou l’installation d’électrolyseurs de petite capacité sont en cours d’élaboration, notamment au sein de l’ISO TC 1974 dédié aux technologies de l’hydrogène.
L’électrolyse à membrane polymère de petite capacité est d’ores et déjà une technologie mature, utilisée depuis plusieurs dizaines d’années pour des applications sous-marines (usines à oxygène à bord des sous-marins nucléaires américains et britanniques) et spatiales (pour la génération d’oxygène dans les compartiments vie de satellites). Les sous-marins nucléaires français sont actuellement équipés d’électrolyseurs alcalins, mais devraient passer prochainement en technologie PEM.
À noter : l’eau pure étant plus rare que l’eau de mer, de plus en plus de systèmes ne disposent que d’eau de mer. Il y a alors deux solutions :
- Soit traiter l’eau de mer comme on le fait dans des installations de dessalement (évaporation ou osmose inverse),
- Soit, comme il a été récemment proposé par le Leiden Institute of Chemistry, de déposer à l’anode, avec l’iridium, un oxyde de manganèse qui y empêcherait la formation de chlore.
Électrolyse à haute température (PCFC ou SOEC)
Cette technologie est directement issue des développements de la pile à combustible de type PCFC ou SOFC (voir schéma), fonctionnant respectivement dans les gammes 400 à 600 °C et 650 à 1000 °C. Elle se révèle intéressante si on l’alimente à la fois en électricité et en chaleur pour maintenir la température élevée souhaitée ; le rendement peut alors être supérieur à 80 % si on ne prend pas en compte la chaleur de vaporisation de l’eau. Cette technologie sépare l’eau en H et O à l’état de vapeur, ce qui demande moins d’énergie. Elle est essentiellement destinée à être couplée à un système solaire à concentration ou à un réacteur nucléaire à haute température. Elle est au stade du développement dans divers laboratoires comme CERAMATEC, Idaho National Engineering and Environmental Lab. aux USA et au CEA/LITEN en France.

Une technologie complémentaire est en cours de développement : il s’agit du couplage des deux fonctions d’électrolyse et de pile à combustible au sein d’un même appareil dans la mesure où l’électrolyse et la pile à combustible sont deux technologies dont les fonctionnements sont réversibles. Diverses entités, publiques et industrielles, commencent, depuis le début 2016, à s’y intéresser en appliquant la technologie SOEC/SOFC ; c’est le cas de la start-up française Sylfen issue du CEA et aux États-Unis de l’association Boeing, Huntington Beach et Sunfire. Le premier démonstrateur Sylfen (Smart Energy Hub, baptisé rSOC) a été validé en mai 2018.





























